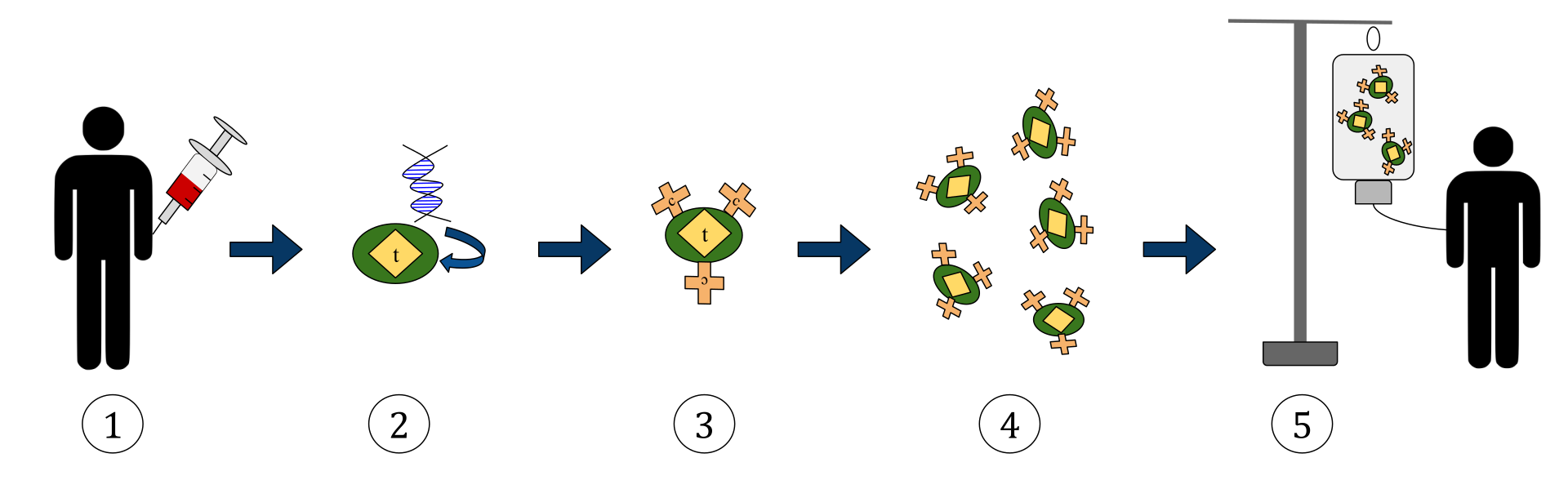
Výše uvedený diagram představuje proces terapie T-buňkami na receptoru chimérického antigenu (CAR). Jedná se o metodu imunoterapie, která je rostoucí praxí v léčbě rakoviny. Konečným výsledkem by měla být produkce vybavených T-buněk, které dokážou rozpoznat a bojovat proti infikovaným rakovinným buňkám v těle.
1. T-buňky (představované objekty označenými jako „t“) jsou odebrány z krve pacienta.
2. Poté se v laboratoři zabuduje gen, který kóduje specifické receptory antigenu, do T buněk.
3. Takto vznikají receptory CAR (označené jako c) na povrchu buněk.
4. Nově upravené T-buňky jsou poté dále sklizeny a pěstovány v laboratoři.
5. Po určitém časovém období se upravené T-buňky infundují zpět do pacienta.
T buňky chimérického receptoru antigenu (také známý jako CAR T buňky) jsou T buňky, které byly geneticky upraveny tak, aby produkovaly umělý receptor T-buněk pro použití v imunoterapii.
Chimérické receptory antigenu (AUTA, také známý jako chimérické imunoreceptory, chimérické receptory T buněknebo receptory umělých T buněk) jsou receptorové proteiny, které byly zkonstruovány tak, aby poskytly T buňkám novou schopnost cílit na konkrétní protein. Receptory jsou chimérické, protože kombinují jak funkce vázání antigenu, tak funkce aktivující T-buňky do jednoho receptoru.
CAR-T buněčná terapie využívá T buňky konstruované s CAR pro terapii rakoviny. Předpokladem imunoterapie CAR-T je upravit T buňky tak, aby rozpoznaly rakovinné buňky, aby je bylo možné účinněji cílit a zničit. Vědci sklízejí T buňky od lidí, geneticky je mění a poté infuzi výsledných buněk CAR-T do pacientů napadají jejich nádory. CAR-T buňky mohou být buď odvozeny z T buněk ve vlastní krvi pacienta (autologní), nebo odvozeny z T buněk jiného zdravého dárce (alogenní). Jakmile jsou izolovány od člověka, jsou tyto T buňky geneticky upraveny tak, aby exprimovaly specifický CAR, který je programuje tak, aby cílily na antigen, který je přítomný na povrchu nádorů. Z bezpečnostních důvodů jsou buňky CAR-T konstruovány tak, aby byly specifické pro antigen exprimovaný v nádoru, který není exprimován ve zdravých buňkách.
Po infuzi CAR-T buněk pacientovi působí jako „živý lék“ proti rakovinovým buňkám. Když přijdou do styku se svým cíleným antigenem na buňce, buňky CAR-T se na něj vážou a aktivují se, poté pokračují v proliferaci a stávají se cytotoxickými. Buňky CAR-T ničí buňky několika mechanismy, včetně rozsáhlé stimulace buněčné proliferace, zvyšování stupně jejich toxičnosti pro jiné živé buňky (cytotoxicita) a způsobování zvýšené sekrece faktorů, které mohou ovlivnit jiné buňky, jako jsou cytokiny, interleukiny růstové faktory.
Výroba buněk CAR-T

Prvním krokem v produkci buněk CAR-T je izolace T buněk z lidské krve. Buňky CAR-T mohou být vyrobeny buď z pacientovy vlastní krve, známé jako autologní léčba, nebo z krve zdravého dárce, známé jako alogenní léčba. Výrobní proces je v obou případech stejný; pouze výběr počátečního dárce krve je jiný.
Nejprve jsou leukocyty izolovány pomocí separátoru krevních buněk v procesu známém jako aferéza leukocytů. Mononukleární buňky periferní krve (PBMC) se poté oddělí a shromáždí. Produkty aferézy leukocytů se poté přenesou do centra pro zpracování buněk. V centru pro zpracování buněk jsou stimulovány specifické T buňky, takže se budou aktivně množit a expandovat do velkého počtu. Aby se podpořila jejich expanze, jsou T buňky typicky ošetřeny cytokinovým interleukinem 2 (IL-2) a anti-CD3 protilátkami.
Expandované T buňky jsou purifikovány a poté transdukovány genem kódujícím upravený CAR prostřednictvím retrovirového vektoru, typicky buď integrujícího gammaretroviru (RV) nebo lentivirového (LV) vektoru. Tyto vektory jsou v moderní době velmi bezpečné kvůli částečnému odstranění oblasti U3. Nový nástroj pro úpravu genů CRISPR / Cas9 byl nedávno použit místo retrovirových vektorů k integraci genu CAR do specifických míst v genomu.
Pacient podstoupí lymfodepleční chemoterapii před zavedením upravených buněk CAR-T. Vyčerpání počtu cirkulujících leukocytů u pacienta zvyšuje regulaci počtu produkovaných cytokinů a snižuje konkurenci o zdroje, což pomáhá podporovat expanzi upravených buněk CAR-T.
Klinické aplikace
V březnu 2019 proběhlo celosvětově přibližně 364 klinických studií zahrnujících buňky CAR-T. Většina těchto studií se zaměřuje na rakovinu krve: terapie CAR-T představují více než polovinu všech studií s hematologickými malignitami. CD19 je i nadále nejoblíbenějším cílem antigenu, následovaný BCMA (běžně exprimovaný v mnohočetném myelomu). V roce 2016 začaly studie zkoumat životaschopnost dalších antigenů, například CD20. Ve studiích se solidními nádory méně dominuje CAR-T, přičemž přibližně polovina studií založených na buněčné terapii zahrnuje jiné platformy, jako jsou NK buňky.
Rakovina
T buňky jsou geneticky upraveny tak, aby exprimovaly chimérické receptory antigenu specificky zaměřené na antigeny na nádorových buňkách pacienta, a poté byly infuze aplikovány pacientovi, kde napadají a zabíjejí rakovinné buňky. CAR modifikované T buňky mohou být konstruovány tak, aby cílily prakticky na jakýkoli antigen spojený s nádorem.
Dřívější výzkum buněk CAR-T se zaměřil na rakovinu krve. První schválené léčby používají CAR, které se zaměřují na antigen CD19, přítomný u rakovin odvozených z B-buněk, jako je akutní lymfoblastická leukémie (ALL) a difúzní velkobuněčný B-buněčný lymfom (DLBCL). Probíhá také úsilí o vývoj CAR zaměřených na mnoho dalších antigenů rakoviny krve, včetně CD30 v refrakterním Hodgkinově lymfomu; CD33, CD123 a FLT3 u akutní myeloidní leukémie (AML); a BCMA u mnohočetného myelomu.
Pevné nádory představovaly obtížnější cíl. Identifikace dobrých antigenů byla náročná: takové antigeny musí být vysoce exprimovány na většině rakovinných buněk, ale z velké části chybí v normálních tkáních. CAR-T buňky také nejsou efektivně přenášeny do středu hmot pevných nádorů a mikroprostředí nepřátelského nádoru potlačuje aktivitu T buněk.
Autoimunitní onemocnění
Zatímco většina studií T-buněk CAR se zaměřuje na vytvoření T-buněk CAR, které mohou vymýtit určitou buněčnou populaci (například CAR T-buňky zaměřené na lymfomové buňky), existuje pro tuto technologii další potenciální využití. T-buňky mohou také chránit vlastní antigeny před autoimunitními reakcemi. Regulační T-buňky vybavené CAR by mohly mít potenciál propůjčit toleranci ke specifickému antigenu, což by mohlo být využito při transplantaci orgánů nebo revmatických onemocněních, jako je lupus.
Uspokojte se
Existují závažné vedlejší účinky, které jsou důsledkem zavedení buněk CAR-T do těla, včetně syndromu uvolnění cytokinů a neurologické toxicity. Jelikož se jedná o relativně novou léčbu, existuje jen málo údajů o dlouhodobých účincích buněčné terapie CAR-T. Stále přetrvávají obavy ohledně dlouhodobého přežití pacientů a komplikací těhotenství u pacientek léčených buňkami CAR-T. Anafylaxe je očekávaným vedlejším účinkem, protože CAR se vyrábí s cizí monoklonální protilátkou a ve výsledku vyvolává imunitní odpověď.
K rozpoznávání na cílovém / mimotumorovém nádoru dochází, když buňka CAR-T rozpozná správný antigen, ale antigen je exprimován na zdravé nepatogenní tkáni. To má za následek, že buňky CAR-T útočí na nenádorovou tkáň, jako jsou zdravé B buňky, které exprimují CD19. Závažnost tohoto nepříznivého účinku se může lišit od aplázie B-buněk, kterou lze léčit pomocí infuzí, až po extrémní toxicitu vedoucí k úmrtí.
Existuje také nepravděpodobná možnost, že upravené CAR-T buňky se samy stanou transformovanými na rakovinné buňky prostřednictvím inzerční mutageneze v důsledku virového vektoru, který vloží gen CAR do tumor supresoru nebo onkogenu v genomu hostitelské T buňky. Některé retrovirové (RV) vektory nesou nižší riziko než lentivirové (LV) vektory. Oba však mají potenciál být onkogenní. Byla provedena analýza genomového sekvenování inzertních míst CAR v T buňkách pro lepší pochopení funkce CAR T buněk a perzistence in vivo.
Syndrom uvolnění cytokinů
Nejběžnějším problémem po léčbě buňkami CAR-T je syndrom uvolnění cytokinů (CRS), stav, při kterém je aktivován imunitní systém a uvolňuje zvýšený počet zánětlivých cytokinů. Klinický projev tohoto syndromu připomíná sepsi s vysokou horečkou, únavou, myalgií, nevolností, kapilárními úniky, tachykardií a jinými srdečními dysfunkcemi, selháním jater a poškozením ledvin. CRS se vyskytuje téměř u všech pacientů léčených CAR-T buněčnou terapií; ve skutečnosti je přítomnost CRS diagnostickým markerem, který naznačuje, že buňky CAR-T fungují tak, jak mají, zabíjet rakovinné buňky. Všimněte si však, že vyšší stupeň závažnosti CRS nekoreluje se zvýšenou odpovědí na léčbu, ale spíše s vyšší zátěží nemocí.
Neurotoxicita spojená s imunitními efektorovými buňkami
Neurologická toxicita je také často spojena s léčbou CAR-T buňkami. Základní mechanismus je špatně pochopen a může nebo nemusí souviset s CRS. Mezi klinické projevy patří delirium, částečná ztráta schopnosti mluvit souvisle a zároveň mít schopnost tlumočit jazyk (expresivní afázie), snížená bdělost (obtundace) a záchvaty. Během některých klinických studií došlo k úmrtím způsobeným neurotoxicitou. Hlavní příčinou úmrtí na neurotoxicitu je mozkový edém. Ve studii provedené společností Juno Therapeutics, Inc., pět pacientů zařazených do studie zemřelo na mozkový edém. Dva z pacientů byli léčeni samotným cyklofosfamidem a zbývající tři byli léčeni kombinací cyklofosfamidu a fludarabinu. V další klinické studii sponzorované Fred Hutchinson Cancer Research Center byl hlášen jeden případ nevratné a fatální neurologické toxicity 122 dní po podání buněk CAR-T.
.
















