Glukagon je peptidový hormon produkovaný alfa buňkami pankreatu. Glukagon zvyšuje koncentraci glukózy a mastných kyselin v krvi a je považován za hlavní katabolický hormon v těle. Glukagon se také používá jako lék k léčbě řady zdravotních stavů. Účinek glukagonu je opačný k účinku inzulínu, který snižuje extracelulární glukózu. Glukagon je produkován z proglukagonu kódovaného genem GCG.
Pankreas uvolňuje glukagon, když je množství glukózy v krvi příliš nízké. Glukagon způsobuje, že se játra účastní glykogenolýzy: přeměna uloženého glykogenu na glukózu, která se uvolňuje do krevního řečiště. Vysoká hladina glukózy v krvi naopak stimuluje uvolňování inzulínu. Inzulin umožňuje absorpci a použití glukózy tkáněmi závislými na inzulínu. Glukagon a inzulín jsou tedy součástí systému zpětné vazby, který udržuje stabilní hladinu glukózy v krvi. Glukagon zvyšuje výdej energie a je zvýšen v podmínkách stresu. Glukagon patří do rodiny hormonů sekretinu.
Funkce glukagonu
Glukagon obecně zvyšuje koncentraci glukózy v krvi podporou glukoneogeneze a glykogenolýzy. Glukagon také snižuje syntézu mastných kyselin v tukové tkáni a játrech. Glukagon podporuje lipolýzu v těchto tkáních, což způsobuje, že uvolňují mastné kyseliny do oběhu, kde je lze v případě potřeby katabolizovat, aby generovaly energii v tkáních, jako je kosterní sval.
Glukóza se ukládá v játrech ve formě polysacharidu glykogenu, což je glukan (polymer tvořený molekulami glukózy). Jaterní buňky (hepatocyty) mají receptory glukagonu. Když se glukagon váže na receptory glukagonu, jaterní buňky přeměňují glykogen na jednotlivé molekuly glukózy a uvolňují je do krevního řečiště, v procesu známém jako glykogenolýza. Když dojde k vyčerpání zásob glukózy, glukagon poté povzbuzuje játra a ledviny k syntéze další glukózy glukoneogenezí. Glukagon vypíná glykolýzu v játrech, což vede k tomu, že glykolytické meziprodukty přecházejí do glukoneogeneze.
Glukagon také reguluje rychlost produkce glukózy lipolýzou. Glukagon indukuje lipolýzu u lidí za podmínek potlačení inzulínu (jako je diabetes mellitus typu 1).
Produkce glukagonu se zdá být závislá na centrálním nervovém systému cestami, které je třeba ještě definovat. U bezobratlých zvířat bylo hlášeno, že odstranění očních stop ovlivňuje produkci glukagonu. Excise eyestalk u mladých raků produkuje hyperglykemii vyvolanou glukagonem.
Mechanismus účinku glukagonu
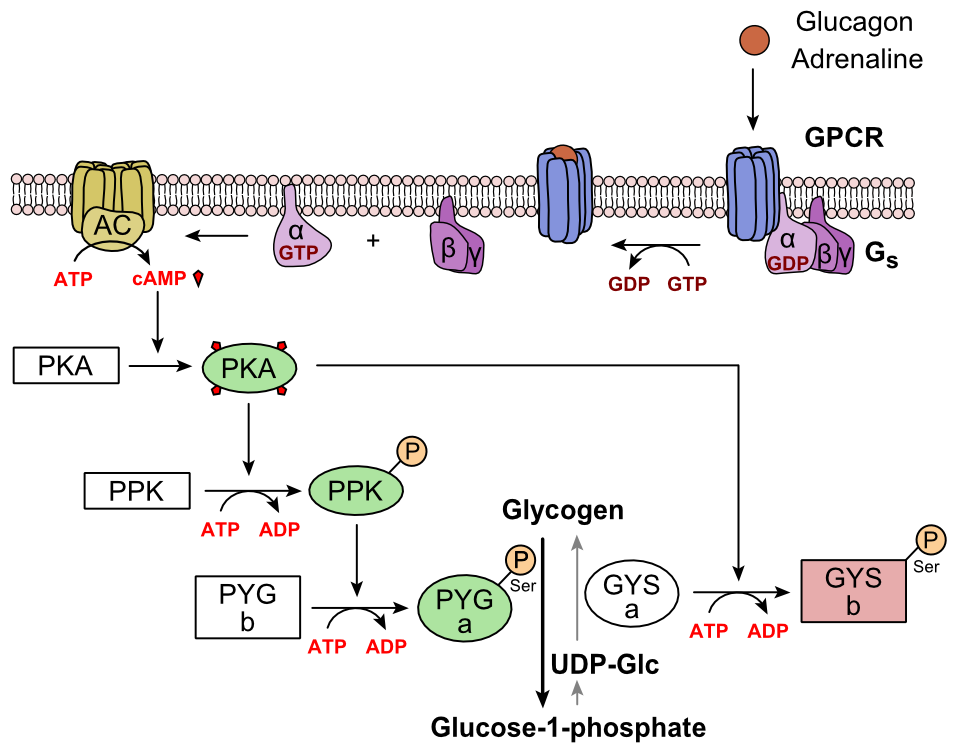
Glukagon se váže na receptor glukagonu, receptor spojený s G proteinem, který se nachází v plazmatické membráně buňky. Konformační změna v receptoru aktivuje G proteiny, heterotrimerní protein s podjednotkami α, β a γ. Když G protein interaguje s receptorem, prochází konformační změnou, která vede k nahrazení molekuly GDP, která byla navázána na a podjednotku, molekulou GTP. Tato substituce vede k uvolnění podjednotky α z podjednotek β a γ. Alfa podjednotka specificky aktivuje další enzym v kaskádě, adenylátcyklázu.
Adenylátcykláza vyrábí cyklický adenosinmonofosfát (cyklický AMP nebo cAMP), který aktivuje proteinkinázu A (protein-kináza závislá na proteinu). Tento enzym zase aktivuje fosforylázovou kinázu, která poté fosforyluje glykogenfosforylázu b (PYG b) a přeměňuje ji na aktivní formu zvanou fosforyláza a (PYG a). Fosforyláza a je enzym odpovědný za uvolňování 1-fosfátu glukózy z glykogenových polymerů.
Příkladem cesty by bylo, když se glukagon váže na transmembránový protein. Transmembránové proteiny interagují s Gɑβ𝛾. Gɑ se odděluje od Gβ𝛾 a interaguje s transmembránovým proteinem adenylylcyklázou. Adenylylcykláza katalyzuje přeměnu ATP na cAMP. cAMP se váže na protein kinázu A a komplex fosforyluje fosforylázu kinázu. Fosforylovaná fosforyláza kináza fosforyluje fosforylázu. Fosforylovaná fosforyláza klipy glukózové jednotky z glykogenu jako 1-fosfát glukózy.
Koordinovaná kontrola glykolýzy a glukoneogeneze v játrech je navíc upravena stavem fosforylace enzymů, které katalyzují tvorbu silného aktivátoru glykolýzy, který se nazývá 2,6-bisfosfát fruktózy. Enzymatická proteinová kináza A (PKA), která byla stimulována kaskádou iniciovanou glukagonem, také fosforyluje jediný serinový zbytek bifunkčního polypeptidového řetězce obsahující jak enzymy fruktózu 2,6-bisfosfatázu, tak fosfofruktokinázu-2. Tato kovalentní fosforylace zahájená glukagonem aktivuje první a inhibuje druhou. To reguluje reakci katalyzující fruktózu 2,6-bisfosfát (silný aktivátor fosfofruktokinázy-1, enzymu, který je primárním regulačním krokem glykolýzy) tím, že zpomaluje rychlost jeho tvorby, čímž inhibuje tok glykolýzy a umožňuje převládat. Tento proces je reverzibilní při absenci glukagonu (a tedy přítomnosti inzulínu).
Stimulace PKA glukagonem také inaktivuje glykolytický enzym pyruvátkinázu v hepatocytech.
Fyziologie
Výroba glukagonu
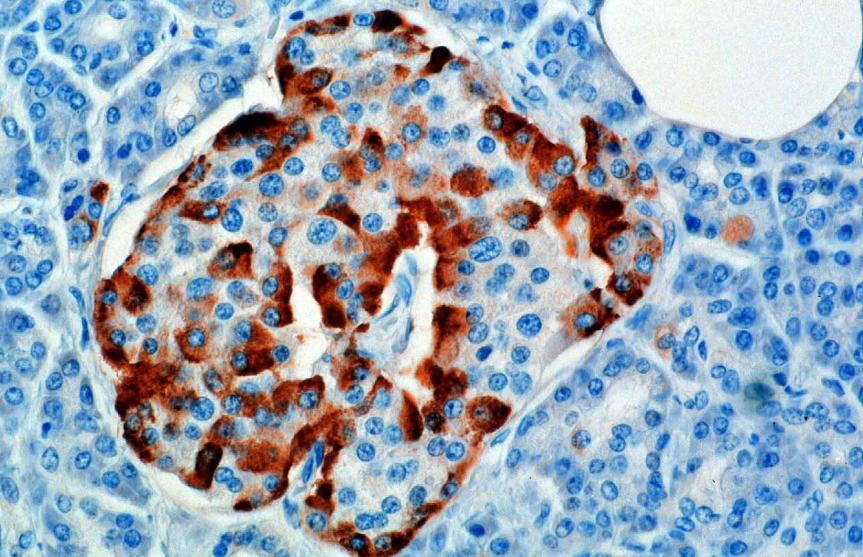
Hormon je syntetizován a vylučován z alfa buněk (α-buněk) Langerhansových ostrůvků, které jsou umístěny v endokrinní části slinivky břišní. Produkce, která je jinak volná, je potlačena / regulována amylinem, peptidovým hormonem vylučovaným společně s inzulínem z beta buněk pankreatu. Jak hladiny glukózy v plazmě ustupují, následné snížení sekrece amylinu zmírňuje jeho potlačení α buněk, což umožňuje sekreci glukagonu.
U hlodavců jsou alfa buňky umístěny ve vnějším okraji ostrůvku. Struktura lidských ostrůvků je mnohem méně segregovaná a alfa buňky jsou distribuovány po celém ostrůvku v těsné blízkosti beta buněk. Glukagon je také produkován alfa buňkami v žaludku.
Nedávný výzkum ukázal, že produkce glukagonu může probíhat také mimo slinivku břišní, přičemž střeva je nejpravděpodobnějším místem syntézy extrapankreatického glukagonu.
Regulace glukagonu
Sekrece glukagonu je stimulována:
- Hypoglykémie
- Epinefrin (prostřednictvím β2, α2 a α1 adrenergních receptorů)
- Arginin
- Alanin (často z transaminace pyruvátem / glutamátem ze svalů
- Acetylcholin
- Cholecystokinin
- Žaludeční inhibiční polypeptid
Sekrece glukagonu je inhibována:
- Somatostatin
- Amylin
- Inzulín (prostřednictvím GABA)
- Heterodimer PPARy / retinoid X receptoru.
- Zvýšené množství volných mastných kyselin a keto kyselin do krve.
- Zvýšená produkce močoviny
- Peptid podobný glukagonu
Struktura glukagonu
Glukagon je polypeptid s 29 aminokyselinami. Jeho primární struktura u lidí je: NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp -Leu-Met-Asn-Thr-COOH.
Polypeptid má molekulovou hmotnost 3485 daltonů. Glukagon je peptidový (nesteroidní) hormon.
Glukagon je generován štěpením proglukagonu proprotein konvertázou 2 v α buňkách ostrůvku pankreatu. Ve střevních L buňkách se proglukagon štěpí na alternativní produkty glicentin, GLP-1 (inkretin), IP-2 a GLP-2 (podporuje růst střev).
Patologie
Abnormálně zvýšené hladiny glukagonu mohou být způsobeny nádory pankreatu, jako je glukagonom, jejichž příznaky zahrnují nekrolytický migrační erytém, snížené aminokyseliny a hyperglykemii. Může nastat samostatně nebo v souvislosti s mnohočetnou endokrinní neoplazií typu 1.
Zvýšený glukagon je hlavním přispěvatelem k hyperglykemické ketoacidóze u nediagnostikovaného nebo špatně léčeného diabetu 1. typu. Jak beta buňky přestávají fungovat, inzulín a pankreatická GABA již nejsou přítomny, aby potlačily volný výstup glukagonu. Ve výsledku se glukagon maximálně uvolňuje z alfa buněk, což způsobuje rychlý rozklad glykogenu na glukózu a rychlou ketogenezi. Bylo zjištěno, že podskupině dospělých s diabetem 1. typu trvalo průměrně 4krát déle, než se přiblížili ketoacidóze, když jim byl podáván somatostatin (inhibuje produkci glukagonu) bez inzulínu. Inhibice glukagonu byla populární myšlenkou na léčbu cukrovky, nicméně někteří varovali, že by to vedlo k křehkému cukrovce u pacientů s adekvátně stabilní hladinou glukózy v krvi.
Nepřítomnost alfa buněk (a tedy i glukagonu) je považována za jeden z hlavních vlivů v extrémní volatilitě glukózy v krvi při stanovení celkové pankreatektomie.
Dějiny
Ve 20. letech 20. století Kimball a Murlin studovali extrakty pankreatu a našli další látku s hyperglykemickými vlastnostmi. Popsali glukagon v roce 1923. Aminokyselinová sekvence glukagonu byla popsána na konci 50. let. Úplnější pochopení jeho role ve fyziologii a nemoci bylo prokázáno až v 70. letech, kdy byla vyvinuta specifická radioimunoanalýza.
.
















