Dědičná nepolypózní kolorektální rakovina (HNPCC), také zvaný Lynchův syndrom, je autozomálně dominantní genetický stav, který je spojen s vysokým rizikem rakoviny tlustého střeva a dalších druhů rakoviny včetně rakoviny endometria (druhá nejčastější), vaječníků, žaludku, tenkého střeva, hepatobiliárního traktu, horních močových cest, mozku a kůže. Zvýšené riziko těchto rakovin je způsobeno zděděnými mutacemi, které zhoršují opravu nesouladu DNA. Jedná se o typ rakovinového syndromu.
Příznaky Lynchova syndromu
Riziko rakoviny
Celoživotní riziko a průměrný věk v době diagnózy rakoviny spojené s Lynchovým syndromem
| Typ rakoviny | Celoživotní riziko (%) | Průměrný věk při diagnóze (roky) |
| Kolorektální | 52-58 | 44-61 |
| Endometria | 25-60 | 48-62 |
| Žaludeční | 6-13 | 56 |
| Ovariální | 4-12 | 42.5 |
Kromě typů rakoviny uvedených v tabulce výše se rozumí, že Lynchův syndrom také přispívá ke zvýšenému riziku rakoviny tenkého střeva, rakoviny pankreatu, rakoviny močovodu / ledvinné pánve, rakoviny žlučových cest, rakoviny mozku a mazových novotvarů. Zvýšené riziko rakoviny prostaty a rakoviny prsu bylo také spojeno s Lynchovým syndromem, i když tento vztah není zcela objasněn.
Dvě třetiny rakoviny tlustého střeva se vyskytují v proximálním tlustém střevě a běžné příznaky a projevy zahrnují krev ve stolici, průjem nebo zácpu a neúmyslný úbytek hmotnosti. Průměrný věk diagnózy kolorektálního karcinomu je u členů rodin, které splňují amsterdamská kritéria, 44 let. Průměrný věk diagnostiky rakoviny endometria je asi 46 let. U žen s HNPCC, které mají jak rakovinu tlustého střeva, tak endometria, je asi polovina přítomna nejprve s rakovinou endometria, takže rakovina endometria je nejčastější sentinelovou rakovinou u Lynchova syndromu. Nejběžnějším příznakem rakoviny endometria je abnormální vaginální krvácení. V HNPCC je průměrný věk diagnostiky rakoviny žaludku 56 let, přičemž nejčastěji uváděnou patologií je adenokarcinom intestinálního typu. Rakoviny vaječníků spojené s HNPCC mají průměrný věk diagnózy 42,5 let; přibližně 30% je diagnostikováno před 40 lety.
Byly nalezeny významné rozdíly v rychlosti rakoviny v závislosti na použité mutaci. Až do věku 75 let byla rizika rakoviny tlustého střeva a konečníku, rakoviny endometria, rakoviny vaječníků, horního gastrointestinálního traktu (žaludku, dvanáctníku, žlučovodů nebo pankreatu), rakoviny močových cest, rakoviny prostaty a mozkových nádorů následující: u mutací MLH1 riziko byla 46%, 43%, 10%, 21%, 8%, 17% a 1%; u mutací MSH2 byla rizika 57%, 17%, 10%, 25%, 32% a 5%; u mutací MSH6 byla rizika 15%, 46%, 13%, 7%, 11%, 18% a 1%.
| Gen | Riziko rakoviny vaječníků | Riziko rakoviny endometria |
|---|---|---|
| MLH1 | 4–24% | 25-60% |
| MSH2 / EPCAM | 4–24% | 25-60% |
| MSH6 | 1-11% | 16-26% |
| PMS2 | 6% (kombinované riziko) | 15% |
Genetika

HNPCC se dědí autozomálně dominantním způsobem. Charakteristickým znakem HNPCC je defektní oprava nesouladu DNA, která způsobuje zvýšenou rychlost změn jednotlivých nukleotidů a nestabilitu mikrosatelitu, také známou jako MSI-H (H je „vysoká“). MSI je identifikovatelný ve vzorcích rakoviny v patologické laboratoři. Většina případů vede ke změnám délek dinukleotidových repeticí nukleobází cytosinu a adeninu (sekvence: CACACACACA…).
4 hlavní geny zapojené do HNPCC normálně kódují funkci proteinů, které tvoří dimery:
- Protein MLH1 dimerizuje s proteinem PMS2 za vzniku MutLα, který koordinuje vazbu dalších proteinů zapojených do opravy nesouladu, jako je DNA helikáza, jednořetězcový vazebný protein DNA (RPA) a DNA polymerázy.
- Protein MSH2 dimerizuje s proteinem MSH6, který identifikuje neshody prostřednictvím posuvného upínacího modelu, proteinu pro skenování chyb.
Poškození některého genu pro proteinový dimer zhoršuje funkci proteinu. Tyto 4 geny se podílejí na opravě chyb (oprava nesouladu), takže dysfunkce genů může vést k neschopnosti opravit chyby replikace DNA a způsobit HNPCC. Je známo, že HNPCC je spojen s dalšími mutacemi v genech zapojených do cesty opravy nesouladu DNA:
| Název OMIM | Geny zapojené do HNPCC | Frekvence mutací v rodinách HNPCC | Místo | První publikace |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2 / EPCAM | přibližně 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | přibližně 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7-10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | relativně zřídka | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | kazuistika | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | kazuistika | 3p22 | |
| HNPCC7 | MLH3 | sporný | 14q24.3 |
Většina lidí s HNPCC dědí tento stav od rodiče. Kvůli neúplné penetraci, proměnlivému věku diagnózy rakoviny, snížení rizika rakoviny nebo předčasné smrti však ne všichni lidé s mutací genu HNPCC mají rodiče, který měl rakovinu. Někteří lidé vyvíjejí HNPCC de-novo v nové generaci, aniž by zdědili gen. Tito lidé jsou často identifikováni až po vzniku rakoviny tlustého střeva v raném věku. Rodiče s HNPCC mají 50% pravděpodobnost přenosu genetické mutace na každé dítě. Je také důležité si uvědomit, že škodlivá mutace v jednom z genů MMR sama o sobě nestačí k vyvolání rakoviny, ale že se musí vyskytnout spíše další mutace v jiných tumor supresorových genech.
Diagnóza Lynchova syndromu
Diagnóza Lynchova syndromu se aplikuje na lidi s mutací zárodečné DNA v jednom z genů MMR (MLH1, MSH2, MSH6 a PMS2) nebo genu EPCAM identifikovaných genetickým testováním. Kandidáti na genetické testování zárodečných linií lze identifikovat podle klinických kritérií, jako jsou Amsterdamská klinická kritéria a pokyny Bethesda, nebo pomocí analýzy nádorů pomocí imunohistochemie (IHC) nebo testování mikrosatelitní nestability (MSI). V USA profesionální společnosti doporučují testovat každý karcinom tlustého střeva na MSI nebo IHC jako screening na Lynchův syndrom, ale to se ne vždy provádí kvůli omezením nákladů a zdrojů. Genetické testování je komerčně dostupné a sestává z krevního testu.
Imunohistochemie
Imunohistochemie (IHC) je metoda, kterou lze použít k detekci exprese proteinu abnormálního nesprávného párování (MMR) v nádorech, které jsou spojeny s Lynchovým syndromem. I když to není diagnostika Lynchova syndromu, může hrát roli při identifikaci lidí, kteří by měli podstoupit testování zárodečné linie. Dvě metody implementace IHC testování zahrnují testování podle věku a univerzální testování pro všechny lidi. V současné době neexistuje široká shoda ohledně toho, která screeningová metoda by měla být použita. Věkové testování IHC bylo navrženo částečně kvůli analýzám nákladů a přínosů, zatímco univerzální testování u všech lidí s kolorektálním karcinomem zajišťuje, že lidé s Lynchovým syndromem nebudou chybět. Vědci se v rámci řešení nákladů snaží předpovědět MSI nebo IHC přímo z pohledu nádoru pod mikroskopem, aniž by prováděli jakékoli molekulární testování.
Mikrosatelitní nestabilita
Mutace v systémech opravy nesouladu DNA mohou vést k potížím s přenosem oblastí v DNA, které obsahují opakující se vzorce dvou nebo tří nukleotidů (mikrosatelitů), jinak známé jako nestabilita mikrosatelitů (MSI). MSI je identifikován extrakcí DNA jak ze vzorku tkáně tumoru, tak ze vzorku normální tkáně, následovanou PCR analýzou mikrosatelitových oblastí. Analýzu MSI lze použít k identifikaci lidí, kteří mohou mít Lynchův syndrom, a nasměrovat je k dalšímu testování.
Klasifikace
Podle histopatologických kritérií lze rozpoznat tři hlavní skupiny rakoviny MSI-H (mikrosatelitní nestabilita – MSI):
- pravostranně špatně diferencované druhy rakoviny
- pravostranné mucinózní rakoviny
- adenokarcinomy v libovolném místě vykazující jakoukoli měřitelnou hladinu intraepiteliálního lymfocytu (TIL)
Histopatologická kritéria nejsou dostatečně citlivá k detekci MSI z histologie, ale vědci se pokoušejí použít umělou inteligenci k předpovědi MSI z histologie.
Kromě toho lze HNPCC rozdělit na Lynchův syndrom I (familiární rakovina tlustého střeva) a Lynchův syndrom II (HNPCC spojený s jinými druhy rakoviny gastrointestinálního traktu nebo reprodukčního systému).
Prevence
Screeningový test
Genetické poradenství a genetické testování se doporučuje rodinám, které splňují amsterdamská kritéria, nejlépe před vypuknutím rakoviny tlustého střeva.
Rakovina tlustého střeva
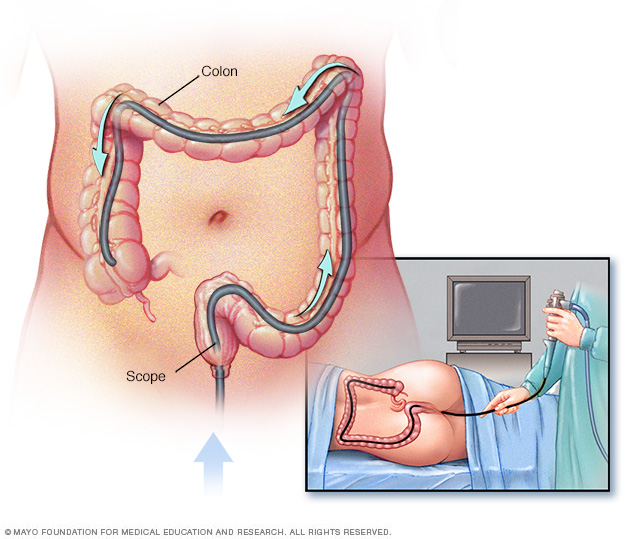
Kolonoskopie se doporučují jako preventivní metoda sledování u jedinců, kteří mají Lynchův syndrom nebo geny spojené s LS. Konkrétně se doporučuje, aby kolonoskopie začínaly ve věku 20–25 let u nosičů mutací MLH1 a MSH2 a od 35 let u nosičů mutací MSH6 a PMS2. Poté by měl být u pacientů s Lynchovým syndromem prováděn kolonoskopický dohled v intervalu 1–2 let.
Rakovina endometria / vaječníků
Při screeningu rakoviny vaječníků a endometria se každoročně doporučuje transvaginální ultrazvuk s nebo bez biopsie endometria. U žen s Lynchovým syndromem lze k testování rakoviny vaječníků použít roční krevní test CA-125, avšak o účinnosti tohoto testu při snižování úmrtnosti jsou k dispozici pouze omezené údaje.
Jiné druhy rakoviny
Existují také strategie pro včasné odhalení jiných druhů rakoviny nebo pro snížení pravděpodobnosti jejich vzniku, o kterých mohou lidé s Lynchovým syndromem diskutovat se svým lékařem, jejich účinnost však není jasná. Mezi tyto možnosti patří:
- Horní endoskopie k detekci rakoviny žaludku a tenkého střeva každých 3–5 let, počínaje nejdříve ve věku 30 let (nejlépe ve výzkumném prostředí)
- Každoroční analýza moči k detekci rakoviny močového měchýře, počínaje nejdříve ve věku 30 let (nejlépe ve výzkumném prostředí)
- Každoroční fyzické a neurologické vyšetření k detekci rakoviny v centrálním nervovém systému (mozku nebo míchě), počínaje nejdříve ve věku 25 let
Amsterdamská kritéria
Níže jsou uvedena amsterdamská kritéria pro identifikaci vysoce rizikových kandidátů pro molekulárně genetické testování:
Kritéria Amsterdam I (musí být splněny všechny odrážky):
- Tři nebo více členů rodiny s potvrzenou diagnózou kolorektálního karcinomu, z nichž jeden je příbuzný prvního stupně (rodič, dítě, sourozenec) ostatních dvou
- Dvě po sobě jdoucí postižené generace
- Jeden nebo více karcinomů tlustého střeva diagnostikovaných do věku 50 let
- Familiární adenomatózní polypóza (FAP) byla vyloučena
Kritéria Amsterdam II byla vyvinuta v roce 1999 a zlepšila diagnostickou citlivost pro Lynchův syndrom zahrnutím rakoviny endometria, tenkého střeva, močovodu a ledvinné pánve.
Amsterdamská kritéria II (musí být splněny všechny odrážky):
- Tři nebo více členů rodiny s rakovinou související s HNPCC, z nichž jeden je příbuzným prvního stupně u ostatních dvou
- Dvě po sobě jdoucí postižené generace
- Jeden nebo více karcinomů souvisejících s HNPCC diagnostikovaných do věku 50 let
- Familiární adenomatózní polypóza (FAP) byla vyloučena
Chirurgická operace
Profylaktickou hysterektomii a salpingo-ooforektomii (odstranění dělohy, vejcovodů a vaječníků, aby se zabránilo rozvoji rakoviny) lze provést před vznikem rakoviny vaječníků nebo endometria.
Léčba Lynchova syndromu
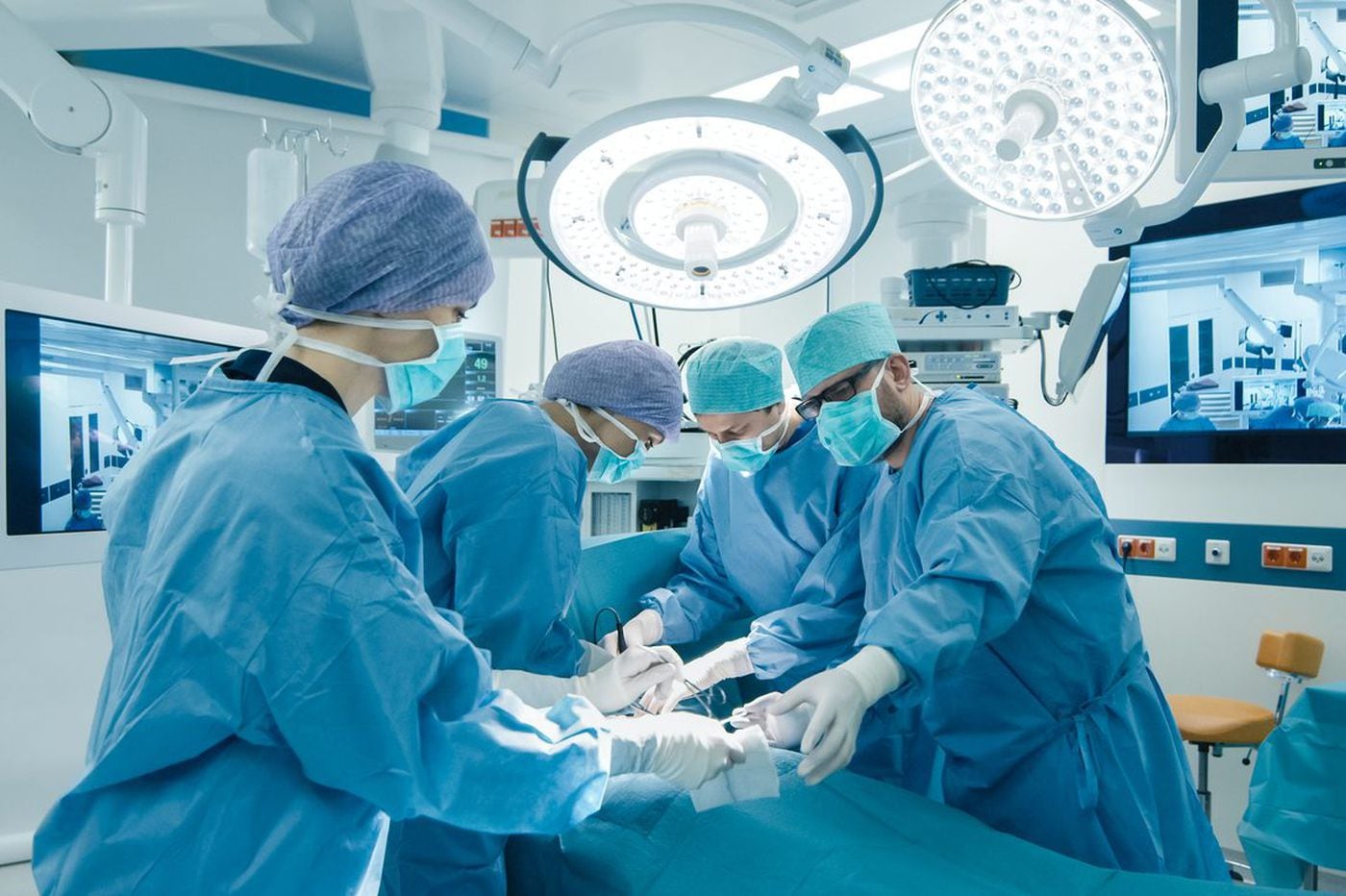
Chirurgie zůstává první linií léčby HNPCC. Pacienti s Lynchovým syndromem, u kterých se vyvine kolorektální karcinom, mohou být léčeni buď částečnou kolektomií nebo celkovou kolektomií s ileorektální anastomózou. Vzhledem ke zvýšenému riziku kolorektálního karcinomu po parciální kolektomii a podobné kvalitě života po obou operacích může být preferovanou léčbou HNPCC celková kolektomie, zejména u mladších pacientů.
O výhodách adjuvantní léčby na bázi 5-fluorouracilu pro kolorektální tumory související s HNPCC, stále probíhají polemiky, zejména u těch ve stadiích I a II.
- Terapie anti-PD-1 protilátkou může být účinná.
Blokování kontrolních bodů s terapií anti-PD-1 je nyní preferovanou první linií léčby pokročilé mikrosatelitové nestability – vysokého kolorektálního karcinomu.
.